







La chloration
Le chlore est un gaz très réactif et très corrosif. Lorsqu'il est transporté, stocké ou utilisé, des mesures de précaution doivent être prises. Le chlore liquide doit être protégé de la lumière du soleil. Le chlore est en effet dissocié sous l'influence de la lumière du soleil, il perd donc de son efficacité. L'efficacité de la désinfection est déterminée par le pH de l'eau. La désinfection au chlore a lieu de façon optimale quand le pH est entre 5.5 et 7.5. Quand le chlore est ajouté à l'eau pour la désinfection, il réagit premièrement avec les composés organiques et inorganiques dissous dans l'eau. Le chlore ne peut plus être employé pour la désinfection parce qu'il a formé d'autres produits. La quantité totale de chlore qui est employé pendant ce processus est désigné sous le nom de demande en chlore de l'eau. Le dosage doit être assez important pour qu'une quantité significative de chlore reste dans l'eau et permette la désinfection. La demande en chlore est déterminée par la quantité de matière organique dans l'eau, du pH , le temps de contact et la température. Le chlore réagit avec la matière organique pour donner des sous-produits de désinfection, tels que les trihalométhanes (THM) et les acides halogéniques acétiques (AHA). Le chlore peut être ajouté pour la désinfection de différentes manières. Quand une chloration ordinaire est appliquée, le chlore est simplement ajouté à l'eau et aucun traitement antérieur n'est nécessaire. Une pré ou une post chloration peuvent être effectuées en ajoutant du chlore à l'eau avant ou après d'autres étapes de traitement. Rechlorination signifie l'addition de chlore à l'eau traitée dans un ou plusieurs points du système de distribution afin de préserver la désinfection. Le palier de chloration consiste en une addition continuelle de chlore à l'eau jusqu'au point où la demande en chlore est annihilée et tout l'ammoniaque présent est oxydé, de sorte que seulement le chlore libre reste. Ceci est habituellement appliqué pour la désinfection, mais il a également d'autres avantages, tels que l'odeur et le contrôle du goût.
Contrairement au chlore, le dioxyde de chlore ne réagit pas avec l'azote ammoniacal (NH3) et réagit très peu avec les amines élémentaires. Il oxyde les nitrites (N02) en nitrates (NO3). Le gaz pur de dioxyde de chlore qui est appliqué à l'eau, produit moins de sous-produits de désinfection que les oxydants, tel que le chlore. Pour le traitement de l'eau potable, le dioxyde de chlore peut être utilisé à la fois comme désinfectant et comme agent d'oxydation. Il peut être utilisé pour les étapes de pré-oxydation et de post-oxydation. En ajoutant du dioxyde de chlore dans l'étape de pré-oxydation du traitement des eaux de surface, le développement des algues et des bactéries peut être évité. Le dioxyde de chlore oxyde les particules flottantes et a un effet bénéfique sur le procédé de coagulation et l'élimination de la turbidité de l'eau. Le dioxyde de chlore est un puissant désinfectant contre les bactérie et les virus. Il est un des nombreux désinfectant efficace contre les parasites Giardia et Cryptosporidium. Le sous-produit, le chlorite (ClO2-), est agent bactéricide faible. Dans l'eau, le dioxyde de chlore est actif en tant que biocide pour au moins 48 heures. Il empêche la croissance des bactéries dans le réseau de distribution de l'eau potable. C'est aussi un agent actif contre la formation de biofilm dans le réseau de distribution. Un biofilm est souvent très dure à défaire. Il forme une couche protectrice sur les microorganismes pathogènes. La plupart des désinfectants ne peuvent atteindre les microoragnismes protégés. Cependant, le dioxyde de chlore élimine les biofilms et tue les microorganismes pathogènes. Le dioxyde de chlore empêche aussi la formation de biofilm parce qu'il reste actif dans le système pendant un long moment. La désinfection au dioxyde de chlore ne cause aucune nuisance odorante. Il détruit les phénols qui peuvent entraîner des problèmes d'odeur et de goût. Le dioxyde de chlore est plus efficace pour l'élimination du fer et du manganèse que le chlore, spécialement lorsqu'ils sont présents sous forme complexe. L'utilisation du dioxyde de chlore au lieu du chlore empêche la formation sous-produits halogénés de désinfection, par exemple les trichlorométhanes et les acides halogénés. Le dioxyde de chlore est un désinfectant plus efficace que le chlore, puisque la concentration requise pour tuer les microorganismes est beaucoup plus faible. Le temps de contact est aussi plus court. Contrairement au chlore, le dioxyde de chlore est efficace à un pH compris entre 5 et 10. La chloramination Les chloramines sont produites par addition de l'ammoniac dans l'eau contenant contenant du chlore libre (HOCl ou OCl, cela dépendant du pH). La valeur idéale du pH pour cette réaction est de 8,4. Cela signifie que l'eau a légèrement un caractère alcalin. 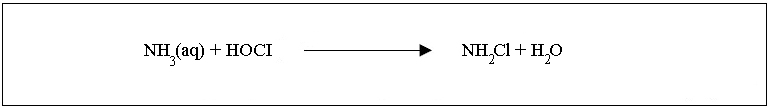 Lorsque la réaction a lieu, trois différents types de chloramines inorganiques peuvent être formés. La valeur du pH détermine quel type de chmoramine sera formé. Les trichloramines sont principalement formées lorsque la valeur du pH est inférieur à 3. Lorque la valeur du pH est supérieure à 7, la concentration en dichloramine sera la plus importante. Les quantités de chlore et d'ammoniac dans l'eau influencent aussi la formation des chloramines. Le taux de chlore/ammoniac idéal est de 6:1. Pendant la production de chloramine, la proportion est normalement 3-5:1. Lorsque la concentration en ammoniac est supérieure plus de dichloramines et de trichloramines seront formées.
La principale raison de l'utilisation de l'utilisation des chloramines à la place du chlore vient du fait que les chloramines réagissent moins que le chlore avec la matière organique. Des sous produits tels que les trihalométhanes sont néanmoins formés lors de la désinfection par chloramine. Les chloramines restent actives plus longtemps dans les canalisations. Les chloramines ne provoquent pas de goûts ou d'odeurs désagréables et sont relativements inoffensifs. Les chloramines sont aussi efficaces que le chlore pour la partie qui concerne la désactivation de bactéries ou autres microorganismes, cependant le mécanisme de réaction est plus lent. Les chloramines comme le chlore sont des agents oxydants. Les chloramines peuvent tuer les bactéries par pénétration de la cellule et blocage du métabolisme. Pendant la désactivation des microoraganismes, les chloramines détruisent les cellules qui protègent les virus. Les résidus actifs de chloramine restent pendant un temps important dans l'eau. Lorsque des chloramines sont présentes, on trouve souvent des traces d'ammoniac et d'hypochlorite dans l'eau. Les chloramines, principalement les monochloramines, sont difficile à éliminer de l'eau. Les chloramines peuvent être éliminées à l'aide de filtre à charbon actif.
En utilisant les chloramines plutôt que le chlore, on réduit la quantité des composés organiques(trihalométhanes; THM) et la formation d'autres sous produits potentiellement cancérigènes (acide halogénique acétique; AHA). Les chloramines restent actives dans l'eau plus longuement que le chlore. Les monochloramines sont plus efficaces lorsque le pH est supérieur ou égal à 7. Les chloramines n'altèrent pas le pH de l'eau. Elles donnent un meilleur gout et une meilleure odeur à l'eau que le chlore. Les chloramines sont souvent utilisées pour adoucir l'odeur et le gout provoqués par le chlore.
Des quantités importantes d'ammoniac servent de nutriments pour pour les bactéries dans l'eau, ce qui peut causer des niveaux importants de nitrate dans l'eau. Lorsque les chloramines sont éliminées chimiquement, de l'ammoniac peut persister dans certains cas. L'effet toxique que l'ammoniac a sur le poisson peut être prévenu par l'application de filtres biologiques, de zéolites naturelles et par contrôle du pH. L'ammoniac provoque la corrosion du plomb et du cuivre. Les poissons peuvent directement absorber les chloramines dans leur sang à travers leurs nageoires. Les chloramines sont donc toxiques pour les poissons. L'eau utilisée pour les aquariums doit donc être dépourvue de chloramines. |
cohorte 2014 - 2015