







|
Les principaux facteurs qui régissent l’équilibre entre le NH3 (ou ammoniac non ionisé) et le NH4+ (ammoniac ionisé ou ammonium ou azote ammoniacal) sont le
pH et la température. Ensemble, ces deux formes désignent l'ammoniac total ou azote ammoniacal total. L'ion ammonium NH4+ n'est pas toxique, par contre il se transforme souvent en ammoniac
NH3 qui, lui, est très toxique. Cette transformation s'opère en présence d’augmentation du pH, ou d’une hausse de la température
de l’eau. Un abaissement du pH ou de la température provoque la réaction inverse et l'ammoniac se transforme à nouveau en NH4+ inoffensif. Il est important de préciser que l'ammoniaque est une solution aqueuse d'ammoniac. Le terme ammoniaque s'applique strictement à la solution aqueuse résultant de la dissolution du gaz ammoniac (NH3) dans l'eau (ammoniac + aqueux). À 20 °C, la forme prédominante dans l'eau potable est l'ion ammonium à pH inférieur à 9,3, et l'ammoniac à pH 9,3 et plus. 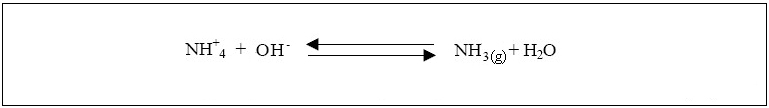 La contamination de l’environnement par l’ammoniac résulte ordinairement de processus urbains, industriels, agricoles et naturels. Les sources naturelles d’ammoniac comprennent la décomposition ou dégradation des débris organiques, les échanges de gaz avec l’atmosphère, les incendies de forêt, les déchets d’origine animale, le rejet d’ammoniac par les organismes et les processus de fixation de l’azote. Les sources ponctuelles d’ammoniac comprennent les émissions et les effluents produits par un grand nombre d’installations industrielles dont les usines sidérurgiques, les usines d’engrais, les raffineries de pétrole et les installations de traitement des viandes. Les plus grandes sources ponctuelles non industrielles sont les stations d’épuration des eaux usées. Nitrification: Durant la nitrification, l’ammoniac (NH3) ou l’ammonium (NH4+) sont oxydés en nitrates (NO3-). La première étape de la réaction appelée nitritation produit d’abord, par oxydation de l’ammonium, des nitrites (NO2-). L’étape suivante, la nitratation, transforment les nitrites en nitrates. Ces étapes sont principalement réalisées par les bactéries du genre Nitrosomonas et Nitrobacter qui sont aérobies et autotrophes; c’est-à-dire qu’elles retirent leur énergie de l’oxydation des nitrites. C'est la nitritation, qui est la transformation de l'ammonium en nitrite, est essentiellement liée aux Nitrosobactéries (genre Nitrosomonas) alors que la nitratation, au cours de laquelle les nitrites sont oxydés en nitrates, est principalement l’oeuvre des Nitrobactéries (genre Nitrobacter). Ces bactéries nitrifiantes, du fait de leur très faible taux de croissance se trouvent en large minorité au sein des boues activées (de 0.1 à 5% de la biomasse totale d’une boue activée). La nitritation est donc l’étape limitante pour la nitrification et on ne constate pas d’accumulation des nitrites dans le milieu en conditions normales de fonctionnement. 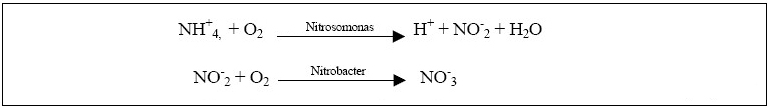 Dénitrification: La dénitrification est un processus de réduction par étapes des formes oxydés de l’azote (NO3-) et (NO2-) en diazote (N2). La dénitrification est assurée par des microorganismes dénitrifiants qui sont largement distribués dans plusieurs familles de bactéries (Pseudomonas, Bacillus, Thiobacillus...). Ces bactéries sont essentiellement hétérotrophes et anaérobies facultatifs. Les microorganismes dénitrifiants sont capables de substituer le (NO3-) à l’oxygène comme accepteur final d’électrons dans des conditions de faible teneur en oxygène ou d’anaérobie . On estime que 25 à 40% de la biomasse d'une boue activée est dénitrifiante facultative. 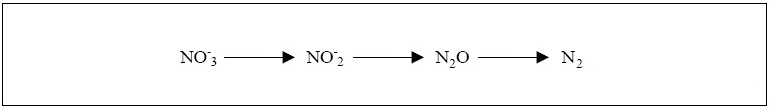 L'objectif de la dénitrification est la réduction des nitrates qui est la principale cause de l'eutrophisation. La dénitrification émet dans l’atmosphère une faible quantité d’oxyde d’azote N2O. La concentration de ce gaz est faible. Cependant, il faut savoir qu’une molécule de N2O est 200 fois plus efficace qu’une molécule de CO2 pour créer un effet de serre. 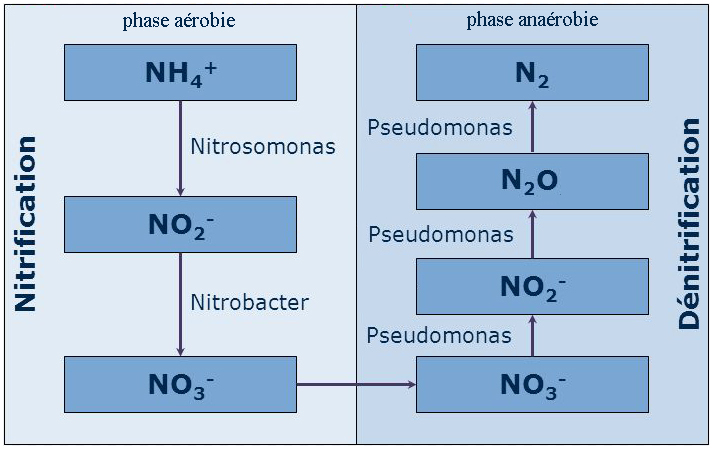 |
cohorte 2014 - 2015